במהלך מגיפת קוביד, ממשלת ארה"ב הוציאה מיליארדי דולרים על כמעט 400 מוצרים שנועדו להגן, לאבחן ולטפל במאות מיליוני אנשים - כולם עם התווית "EUA" או "הרשאת שימוש חירום".
אבל מה המשמעות של EUA בעצם?
עוד לפני שנענה על השאלה הזו, וכדי להבין היכן עומדת EUA ביחס למסלולים אחרים לאישור או אישור מוצרים רפואיים, כדאי להסתכל על מה EUA אינו:
EUA אינו ייעוד למוצר ניסיוני שעובר ניסוי קליני
אם אנחנו מבינים רק דבר אחד לגבי EUA זה צריך להיות זה: EUA אינו חל על מוצר שעובר ניסוי קליני כפוף לתקנות ה-FDA או דרישות משפטיות אחרות.
EUA גם אינו זהה ל-Expand Access Use (EAU), המכונה לעתים קרובות "שימוש בחמלה", החלה על הענקת גישה לחולים עם מחלות קשות וחשוכות מרפא למוצרים ניסיוניים לפני שהם מאושרים במלואם.
השולחן הזה מא מצגת FDA-CDC 2020 מסכם את ההבדלים בין מוצרים שעוברים ניסויים קליניים, מוצרים שניתנו למטופלים באמצעות גישה "חמלה" מורחבת, ומוצרים המורשים דרך EUA:
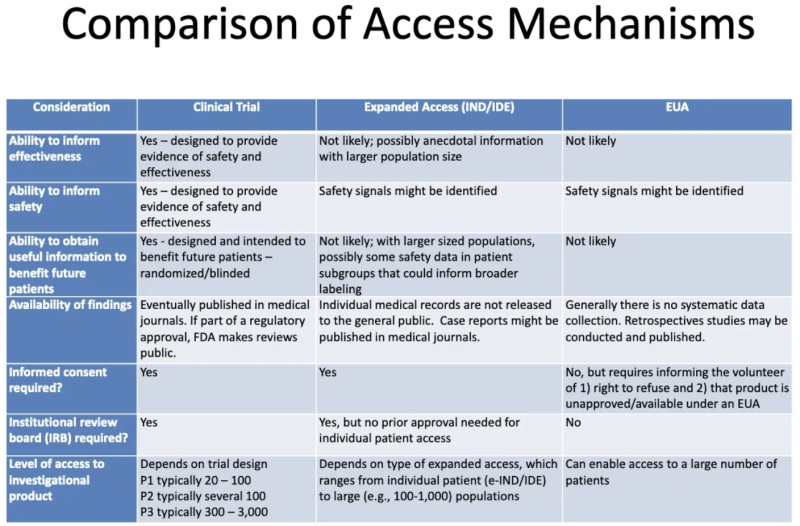
הנה מה שהטבלה הזו מספרת לנו על EUA:
- תהליך הענקת EUA לא צפוי לייצר מידע כלשהו על יעילות המוצר.
- תהליך הענקת EUA לא נועד לספק ראיות לבטיחות או יעילות, אך ייתכן שיזוהו אותות בטיחות.
- אין זה סביר, ברגע שמוצר יקבל EUA וניתן לחלק מהמטופלים, שמידע שימושי יתקבל לטובת מטופלים עתידיים.
- אין איסוף נתונים שיטתי על יעילות או בטיחות עם EUA, ולא מתפרסמים נתונים בכתבי עת רפואיים כחלק מתהליך האישור הרגולטורי.
- לא נדרשת הסכמה מדעת, אך יש לומר למטופלים ש"מתנדבים" לקחת את המוצר שהם יכולים לסרב ושהמוצר אינו מאושר/זמין במסגרת EUA.
- אין צורך בוועדת ביקורת מוסדית (IRB). [IRB הוא לוח שאמור להגן על רווחתם של נבדקים אנושיים בניסויים קליניים]
כדי להבהיר עוד יותר עד כמה נפרדת EUA מכל תהליך אישור רגיל, ב- 2009 פרסום המכון לרפואה של האקדמיות הלאומיות, אנו מוצאים את ההצהרה הזו:
חשוב להכיר בכך ש-EUA אינו חלק ממסלול הפיתוח; זוהי ישות נפרדת לחלוטין המשמשת רק במצבי חירום ואינה חלק מתהליך אישור התרופה. (עמ' 28)
לסיכום:
לא סביר שתהליך הענקת מוצר EUA יניב עדות כלשהי לבטיחות או יעילות. ברגע שמוצר מוענק EUA ומינתן לחולים, אין זה סביר שיתקבל מידע שימושי כלשהו שיועיל לחולים עתידיים, מכיוון שאין איסוף נתונים שיטתי על יעילות או בטיחות.
בהתבסס על כל המידע המאוד ברור הזה מה-CDC/FDA וה-IMNA, יהיה זה הוגן להסיק שאישור שימוש חירום הוא תהליך שיש ליישם בצורה מאוד נבונה ורק במקרים של מצבי חירום קשים.
עכשיו בואו נסתכל על אילו סוגי מצבי חירום EUA נועד לטפל באופן חוקי.
EAU מיועד למקרי חירום של נשק להשמדה המונית
החוקים המתירים את "מנגנון הגישה" של ה-EUA שתוארו לעיל נוצרו עבור מקרים של מצבי חירום קיצוניים מיידיים הכוללים נשק להשמדה המונית (WMD), המכונים גם CBRN (כימיים, ביולוגיים, רדיולוגיים, גרעיניים).
הנה איך מנהל המזון והתרופות (FDA) מתאר את סמכויות ה-EUA שלו:
סעיף 564 של FD&C Act (21 U.S.C 360bbb–3) מאפשר ל-FDA לחזק את ההגנה על בריאות הציבור מפני חומרים ביולוגיים, כימיים, גרעיניים ורדיולוגיים.
עם רשות ה-EUA הזו, ה-FDA יכול לעזור להבטיח שניתן להשתמש באמצעי נגד רפואיים במצבי חירום כדי לאבחן, לטפל או למנוע מחלות או מצבים חמורים או מסכני חיים הנגרמים על ידי גורמים ביולוגיים, כימיים, גרעיניים או רדיולוגיים, כאשר אין מספיקים מאושרים , וחלופות זמינות (בין יתר הקריטריונים).
סמכויות אלו של EUA הוענקו בשנת 2004 בנסיבות מאוד ספציפיות הקשורות למוכנות להתקפות של סוכני CBRN.
כפי שהוסבר בחוק הבריאות של הרווארד,
בסופו של דבר, המלחמה בטרור היא שתוליד אישור שימוש חירום. לאחר אירועי ה-11 בספטמבר 2001 והתקפות הדואר האנתרקס הבאות, הקונגרס חוקק את Project Bioshield Act משנת 2004.
השמיים שיא מצביע על כך שהקונגרס התמקד באיום של טרור ביולוגי במיוחד, לא בהכנות למגיפה טבעית.
בהתחשב בסוג כה צר של מצב חירום קיצוני באמת הכרוך בהתקפת נשק להשמדה המונית, ניתן להבין מדוע "מנגנון הגישה" של ה-EUA אינו מצריך פיקוח רגולטורי רב או עמידה בתקני ייצור או ניסויים קליניים כלשהם.
אז מה בעצם דורש מנגנון הגישה ל-EUA?
שלושת השלבים לאישור שימוש חירום (EUA)
שלושה דברים צריכים לקרות כדי ש-EUA יוענק למוצר רפואי:
- השר לביטחון פנים, שר ההגנה או שר הבריאות ושירותי האנוש צריכים לקבוע שיש מצב חירום הכרוך בהתקפה או איום בהתקפה עם סוכן CBRN או מחלה שנגרמה על ידי סוכן כזה.
- ה-FDA צריך לוודא שהוא עומד בארבעה "קריטריונים סטטוטוריים" כאשר הוא מנפיק את ה-EUA.
- על ה-FDA "להטיל תנאים נדרשים מסוימים" ב-EUA.
EUA שלב 1: הכרזה על מצב חירום CBRN
הצהרת החירום עבור EUA נפרדת ואינה קשורה לכל הצהרת חירום אחרת שעשויה להינתן על ידי הנשיא, מזכיר ה-HHS או כל אחד אחר. יש להנפיק אותו במיוחד למטרת הפעלת EUA וניתן לסיים אותו או להאריך אותו ללא תלות בכל הצהרת חירום אחרת.
הנה מה החוק ה-EUA קובע הם ארבעת התרחישים האפשריים להפעלת "מנגנון הגישה" של EUA:
- קביעה של המזכיר לביטחון פנים כי קיים מצב חירום מקומי, או פוטנציאל משמעותי למצב חירום ביתי, הכרוך בסיכון מוגבר להתקפה עם גורם או סוכנים ביולוגיים, כימיים, רדיולוגיים או גרעיניים;
- קביעה של שר ההגנה כי קיים מצב חירום צבאי, או פוטנציאל משמעותי למצב חירום צבאי, הכרוך בסיכון מוגבר ל מאוחד הברית כוחות צבא, לרבות כוח אדם הפועל תחת סמכות כותרת 10 או כותרת 50, להתקפה עם-
- גורם או סוכנים ביולוגיים, כימיים, רדיולוגיים או גרעיניים; אוֹ
- סוכן או סוכנים שעלולים לגרום, או קשורים אחרת, לסכנת חיים וסיכון ספציפי עבור יונייטד הברית כוחות צבא;
- קביעה של ה המזכירה [של שירותי בריאות ושירותי אנוש] שקיים מצב חירום בבריאות הציבור, או פוטנציאל משמעותי למצב חירום בבריאות הציבור, שמשפיע, או שיש לו פוטנציאל משמעותי להשפיע, על הביטחון הלאומי או על הבריאות והביטחון של מאוחד הברית אזרחים המתגוררים בחו"ל, ואשר מערבים גורם או גורמים ביולוגיים, כימיים, רדיולוגיים או גרעיניים, או מחלה או מצב שניתן לייחס לגורם או גורמים כאלה; אוֹ
- זיהוי איום מהותי לפי סעיף 319ו–2 ל חוק שירות בריאות הציבור [42 U.S.C 247ד–6ב] מספיק כדי להשפיע על הביטחון הלאומי או על הבריאות והביטחון של מאוחד הברית אזרחים החיים בחו"ל.
EUA שלב 2. עמידה בקריטריונים הסטטוטוריים
ברגע שאחד המזכירים הכריז שיש מצב חירום שמצדיק את ה-EUA, יש עוד ארבעה "קריטריונים סטטוטוריים" שצריך לעמוד בהם כדי שה-FDA יוציא את ה-EUA. כך מסביר ה-FDA את הדרישות הללו:
- מחלה או מצב חמור או מסכן חיים
כדי שה-FDA ינפיק EUA, חומרי ה-CBRN המוזכרים בהצהרת ה-EUA של מזכיר ה-HHS חייבים להיות מסוגלים לגרום למחלה או מצב חמור או מסכן חיים.
- עדות ליעילות
מוצרים רפואיים שעשויים להיחשב ל-EUA הם כאלה ש"עשויים להיות יעילים" למניעה, אבחון או טיפול במחלות או מצבים חמורים או מסכני חיים שיכולים להיגרם על ידי סוכן(ים) CBRN שזוהו בהצהרת מזכיר ה-HHS של חירום או איום חירום לפי סעיף 564(ב).
התקן "עשוי להיות יעיל" עבור EUAs מספק רמה נמוכה יותר של ראיות מאשר תקן ה"יעילות" שבו משתמש ה-FDA לאישורי מוצרים. ה-FDA מתכוון להעריך את היעילות הפוטנציאלית של מוצר EUA אפשרי על בסיס כל מקרה לגופו תוך שימוש בניתוח סיכון-תועלת, כפי שיוסבר להלן.
[BOLDפנים נוספו]
- ניתוח סיכון-תועלת
ניתן לשקול מוצר עבור EUA אם הממונה יקבע כי היתרונות הידועים והפוטנציאליים של המוצר, כאשר משתמשים בו לאבחון, מניעה או טיפול במחלה או במצב שזוהו, עולים על הסיכונים הידועים והפוטנציאליים של המוצר.
בקביעה האם היתרונות הידועים והפוטנציאליים של המוצר עולים על הסיכונים הידועים והפוטנציאליים, ה-FDA מתכוון להסתכל על מכלול הראיות המדעיות לקביעת סיכון-תועלת כוללת. ראיות כאלה, אשר יכול להתעורר ממגוון מקורות, עלול להכיל (אך לא מוגבל ל): תוצאות של ניסויים קליניים מקומיים וזרים, נתוני יעילות in vivo ממודלים של בעלי חיים ונתוני מבחנה, זמין לשיקול ה-FDA. ה-FDA גם יעריך את האיכות והכמות של ראיות זמינות, בהתחשב במצב הידע המדעי הנוכחי.
[BOLDפנים נוספו]
- אין חלופות
על מנת שה-FDA ינפיק אישור EUA, לא חייבת להיות חלופה נאותה, מאושרת וזמינה למוצר המועמד לאבחון, מניעה או טיפול במחלה או במצב. מוצר חלופי פוטנציאלי עשוי להיחשב "לא זמין" אם אין מספיק אספקה של החלופה המאושרת כדי לענות באופן מלא על צורך החירום.
EUA שלב 3. הטלת התנאים הנדרשים
ברגע שיש לנו את הצהרת החירום הספציפית ל-EUA, וברגע שה-FDA יקבע שהמוצר עשוי להיות יעיל ושכל הראיות הקיימות מראה שהיתרונות שלו עולים על הסיכונים שלו, יש עוד שכבה אחת של רגולציה קשורה.
הנה איך א דו"ח שירות המחקר של הקונגרס לשנת 2018 על EUA מסביר את זה:
FFDCA §564 מורה ל-FDA להטיל תנאים נדרשים מסוימים ב-EUA ומאפשר תנאים שיקול דעת נוספים במידת הצורך. התנאים הנדרשים משתנים בהתאם אם ה-EUA מיועד למוצר לא מאושר או לשימוש לא מאושר במוצר מאושר. עבור מוצר לא מאושר, תנאי השימוש חייבים:
(1) להבטיח שאנשי מקצוע בתחום הבריאות הנותנים את המוצר יקבלו מידע נדרש;
(2) להבטיח שאנשים שהמוצר מנוהל להם יקבלו מידע נדרש;
(3) לדאוג לניטור ודיווח על תופעות לוואי הקשורות למוצר; ו
(4) להקפיד על רישום ודיווח על ידי היצרן.
סיכום
כפי שצוין במאמר זה, ה-FDA/CDC מכירים בבירור בכך שתהליך הענקת הרשאת שימוש בחירום (EUA) אינו סביר לייצר מידע כלשהו על היעילות או הבטיחות של מוצר. כאשר אנו מסתכלים על נוסח החוק המסדיר את EUA, אנו רואים שזו אכן הערכה נכונה.
חוק ה-EUA אינו כופה תקנים משפטיים או רגולטוריים שעשויים לקבוע אם מוצר בטוח או יעיל. הסטנדרטים היחידים הם האם ה-FDA מאמין שהמוצר עשוי להיות יעיל וכי היתרונות הידועים שלו עולים על נזקיו הידועים. אם אין נזקים ידועים או יתרונות ידועים, מכיוון שהמוצר מעולם לא עבר תהליך אישור התרופה, ה-FDA יכול להשתמש בכל מידע או סטנדרטים שהוא בוחר כדי לקבוע את זה.
מכל זה נובע שחברה שהמוצר שלה מועמד ל-EUA עשויה לנסות להוכיח את בטיחות המוצר ו/או יעילותו בכל אמצעי שתבחר. קיומו של ניסיון כזה (בין אם ניסוי קליני או מנגנון אחר של איסוף נתונים), והאופן שבו ניסיון זה מתנהל, הכל תלוי בחברה. שום דבר בחוק ה-EUA אינו חל על האופן שבו החברה מעצבת, מבצעת או מנתחת מחקרים או מנגנוני איסוף נתונים אחרים שהיא בוחרת לבצע.
מיושם על מוצרי Covid המשמעות היא:
- לא נדרשו נתוני בטיחות או יעילות מניסויים קליניים על מנת שמוצרי Covid יקבלו EUA.
- כל הניסויים הקליניים שהוזכרו בתהליך ה-EUA נערכו ללא תקנים רגולטוריים ישימים מבחינה חוקית.
- כאשר אנו מגלים שלמוצרים אלו אין יעילות או בטיחות, זו לא הפתעה. זוהי תוצאה סבירה מאוד של התהליך.
- אין נתונים מתהליך ה-EUA שעליהם ניתן לבסס החלטות שאינן ב-EUA לגבי בטיחות או יעילות המוצר. אז כל שימוש שאינו ב-EUA במוצר יחייב לעבור את תהליך האישור החוקי של מוצרים רפואיים רגילים מההתחלה.
עוד על תהליך האישור של חיסוני קוביד כאן.
פורסם מחדש מאת המחבר המשנה
פורסם תחת א רישיון בינלאומי של Creative Commons ייחוס 4.0
עבור הדפסות חוזרות, נא להחזיר את הקישור הקנוני למקור מכון ברונסטון מאמר ומחבר.









